分子生物学

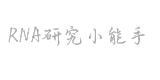

100μM的引物为啥不能直接跑qPCR?不稀释会怎么样?

大多数Oligo最终都是干粉形式,如果合成量足够多,能够在管子底部看到透明或类白色的薄片。通常建议配成浓度为100 μM母液保存,再稀释配制工作液使用。为什么不直接用母液去跑qPCR啊?
刚好最近客户就有这样的情况,一开始他就是直接用100 μM的引物去跑的,结果给大家看看。
100uM的引物跑的(20ul体系上0.4ul的引物F和引物R)
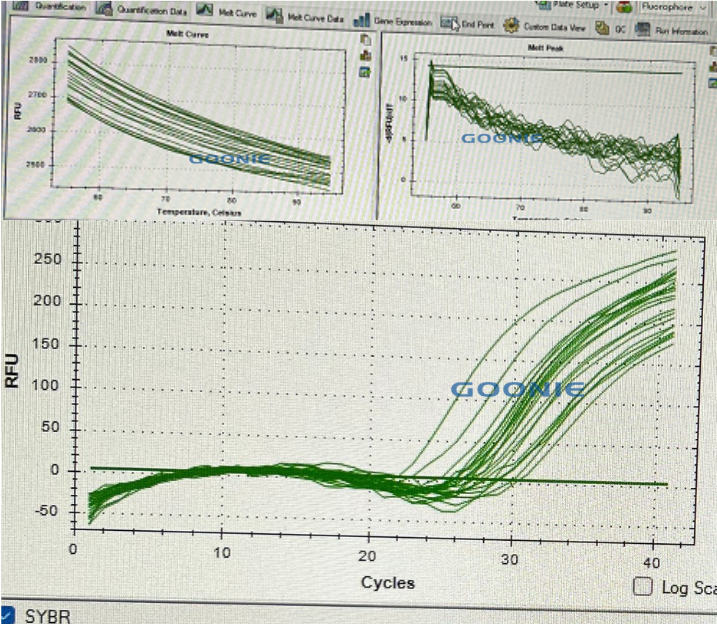
一开始看到这样的图,我们也没搞清楚,怎么回事。去到实验室了解之后,才发现是直接用母液跑的qPCR。经过调整,结果如下。
10uM的引物跑的(20ul体系上0.4ul的引物F和引物R)
当引物浓度过高时,引物分子之间(尤其是正向和反向引物之间)相遇并互补结合的概率大大增加,即使它们与模板DNA并不完全匹配。酶会以这种“引物二聚体”为模板进行延伸,生成短小的、非特异性的PCR产物。
后果:
竞争资源:引物二聚体会与目标基因竞争反应体系中的DNA聚合酶、dNTPs等宝贵资源,导致目标产物的扩增效率下降。
荧光背景升高:在SYBR Green法中,染料会嵌入任何双链DNA中。引物二聚体也是双链,会被染料标记,产生强烈的荧光信号。这会大幅提高反应的背景荧光,使得在早期循环中难以准确识别真正的目标基因扩增信号(Ct值)。
熔解曲线异常:在熔解曲线分析中,引物二聚体通常会在较低的温度下解链,形成一个或多个杂峰,干扰对目标产物单一性的判断,甚至导致误判为非特异性扩增。
原理:引物在低严谨性条件下(如退火温度并非最优时)可能会与模板DNA上相似但不完全匹配的序列结合。过量的引物加剧了这种错配结合的发生概率。
后果:除了目标片段,还会扩增出大小不一的非目标片段。这会消耗反应组分,降低目标产物的产量,并使定量结果(Ct值)严重失真。
原理:PCR反应体系中的各组分是经过精密优化的。过量的引物本身或其形成的引物二聚体,在高浓度下可能会对DNA聚合酶产生一定的抑制作用。
后果:目标基因的扩增效率会显著降低。一个理想的qPCR反应效率应在90%-110%之间(斜率约为-3.1到-3.6)。引物过量会导致效率远低于90%,使得定量结果不可信。标准曲线会变得平缓,灵敏度下降。
引物是实验成本的一部分。使用过量的引物不仅不会带来任何好处,反而是一种浪费。

本篇文章来源于微信公众号:信天翁GOONIE






